Технология компьютерного анализа спермы (Computer-aided sperm analysis, CASA) была разработана в конце 1980-х гг. для анализа характеристик подвижности и кинематики сперматозоидов и стала весьма успешной в этой области исследований. Компьютерный анализ также с большим успехом был использован при измерении таких показателей как концентрация сперматозоидов и оценка поступательной подвижности сперматозоидов у многих видов животных, а также широко применялся в лабораториях по выведению одомашненных животных и в репродуктивной токсикологии. Однако попытки использовать CASA для клинического анализа семенной жидкости человека по большому счету не принесли положительных результатов, это связано с характерными патологическими изменениями во многих образцах спермы человека, вызванных агрегацией сперматозоидов и большого количества фонового дебриса, что до настоящего времени делало невозможным получение качественного цифрового изображения для проведения анализа. Авторы статьи рассматривают усовершенствованные характеристики двух современных систем CASA (CASA-II и Microptic SCA 6) и анализируют особенности их текущего и будущего применения с определенной ссылкой на привлечение нашего внимания к использованию данной технологии, чтобы получить доступ именно к функциональным, а не простым описательным характеристикам спермия. Существуют определенные технические требования для валидации технологии CASA как полуавтоматизированной системы анализа человеческой спермы, особое внимание уделяется точности и погрешности измерений, ожидаемых от надежного медицинского лабораторного метода для применения в клинических лабораториях в соответствии с современными стандартами аккредитации.
ИСТОРИЧЕСКОЕ ВВЕДЕНИЕ
Интерес к оценке движения сперматозоидов и к попыткам понять, что оно может сообщить нам о биологии спермы и ее функциональной компетенции, появился шесть десятилетий назад в классических работах, опубликованных Лордом Ротшильдом (Rothschild), Греем 2(Gray), Рикменспоелем (Rikmenspoel) и их коллегами.1-5 Тем не менее, «современная эра» кинематики сперматозоидов у высших животных, основанная первоначально на ручной оценке подвижности сперматозоидов, впервые появилась в 1970-х гг. в работе группы профессора Джорджа Дэвида (George David) в Ле-Кремлен-Бисетр (Париж, Франция) и в лаборатории Гектора Дотта (Hector Dott) в Кембридже (Великобритания), которые разрабатывали способы использования микрофотографии и микрокинематографии для количественной оценки подвижности сперматозоидов.6-7 Дэвид Кац (David Katz) и Джим Оверстрит (Jim Overstreet) из г. Дейвис (Калифорния, США) расширили основную работу по микрокиносъемке спермы, они впервые использовали видеосъемку при анализе спермы под микроскопом, и эту методику быстро подхватили другие ученые.10,11 Существует несколько основных обзорных статей на тему подвижности сперматозоидов высших животных и их анализа.12-15 Основной критерий для оценки кинематики сперматозоидов (характеристики, которой описывают движение сперматозоидов, в отличие от количественного соотношения подвижных клеток), который мы используем сегодня, был сформулирован в работе группы Дэвида (George David) во время использования микрокиносъемки со скоростью 50 кадров в секунду.7 Растущий интерес к данной области привел к появлению запутанной терминологии и определению различных кинематических критериев, но они были пересмотрены в 1988 году 16 и приняты ВОЗ в 3-м издании их руководства по лабораторному исследованию спермы в 1992 году.17 Единое мнение, к которому пришли почти все эксперты, занятые в то время в данной области, включало трехбуквенное обозначение измеряемых параметров (например, VCL, LIN, ALH, и т.д.), а также точность предоставления результатов: измеренные параметры, такие как скорости - до 1 знака после запятой, а коэффициенты представлять целыми процентными значениями.
С появлением персонального компьютера в 1980 году, и развитием технологии оцифровки видео изображений для автоматического построения отдельных треков спермы и их анализа, произошел всплеск интереса к этой области исследований, и появились первые коммерческие CASA (компьютерный анализ спермы) системы 16: CellSoft в 1985 году, вышедшая вскоре после Hamilton-Thorn HTM-2000. В 1992 году компания Sperm Motility Quantifier (SMQ) создала одну из первых систем, позволяющих провести обычный анализ спермы при частоте кадров 50 Гц.
Так как эта область развивалась и дальше, некоторые ученые хотели перейти от использования компьютерного анализа спермы CASA в качестве исследовательского инструмента, разработанного для анализа подвижности сперматозоидов и их кинематики, к тому, чтобы использовать данную систему для автоматизированного анализа спермы человека в клинических условиях. К сожалению, из-за основных недостатков в технологии анализа изображений (в основном из-за ограниченного разрешения доступных тогда цифровых камер), эта идея была неудачной с точки зрения точности по сравнению со стандартным ручным анализом, выполненным обученными специалистами.19,20 К этому главному недостатку системы CASA 1980-х и 1990-х годов для анализа спермы человека апеллировали на трех согласительных совещаниях: в октябре 1994 в городе Кэрнс на 7 симпозиуме по сперматологии, и в двух семинарах, проводимых Европейским сообществом по вопросам репродукции человека и эмбриологии (ESHRE) в Гамбурге и Сан-Миниато, в июне 1995 года и апреле 1997 года соответственно. В доклад симпозиума в Сан-Миниато 1998 года были включены следующие рекомендации, выработанные на основе консенсуса, в отношении использования компьютерной системы CASA для анализа спермы человека:
#14. Определение концентрации спермы не должно быть основной причиной для приобретения прибора CASA
#15. Если пользователь желает использовать прибор CASA для определения концентрации спермы, то он / она должен(а) доказать, что предполагаемая техника измерений обеспечивает точные результаты по сравнению с общепринятыми, надежными методами (например, метод подсчета клеток в гемоцитометре, утвержденный ВОЗ и, возможно, метод проточной цитометрии; ВОЗ, 199217)
#16. Считается, что нынешнее поколение аппаратов CASA не обеспечивает точные, воспроизводимые значения концентрации сперматозоидов, до тех пор пока система не сможет отличить сперматозоиды от других клеток и дебриса с помощью определенного метода окрашивания, например, флуоресцентной окраски ДНК с количественным определением размера ядра (Зинаман (Zinaman) и др., 1996)
#17. Определение концентрации подвижных сперматозоидов не следует рассматривать основной причиной покупки аппарата для компьютерного анализа спермы CASA
#18. При использовании в проведении повседневных анализов семенной жидкости, инструменты CASA должны быть использованы для определения концентрации прогрессивно-подвижных сперматозоидов. Компьютерный анализ CASA может определить эту величину точно, если были предприняты меры по подготовке образца, использованию инструмента, и были учтены соответствующие пользовательские критерии (Мортимер (Mortimer) и др., 1995).21 Существующие инструменты системы CASA не должны использоваться для определения доли подвижных сперматозоидов, так как они не могут различать дебрис и мертвые сперматозоиды, и в то же время определять живые сперматозоиды.
#31.Современное поколение инструментов CASA не способно анализировать человеческую морфологию сперматозоидов в порядке, необходимом для повседненых использований в клинических условиях. В частности, неспособность включить анализ шейки и хвоста сперматозоида (как этого требуют рекомендации ВОЗ) считается основным недостатком. Следовательно, использование инструментов CASA для клинической оценки морфологии спермы человека в настоящее время не поддерживается (ВОЗ, 1992).
Следует подчеркнуть, что эти пункты соглашения отражают ситуацию в 1998 году, - но, если система компьютерного анализа спермы CASA не задействует в работе значительно улучшенную технологию и / или программное обеспечение, то те же затруднения и недостатки будут иметь место и сегодня. Почти через 20 лет после встречи в городе Кэрнс, полагали, что будет целесобразным в 12-й Симпозиум по вопросам сперматологии 2014 года включить семинар по нынешним и будущим возможностям технологий CASA, основываясь на личном опыте авторов двух систем CASA «следующего поколения», которые включают в себя улучшенные возможности.
ОЖИДАНИЯ ДОСТОВЕРНОСТИ И ТОЧНОСТИ МЕДИЦИНСКИХ ЛАБОРАТОРНЫХ ИСПЫТАНИЙ
Основополагающие стандарты для всех медицинских лабораторий являются общеприменимыми и четко определены в ISO 15189:2007. Как и для любого медицинского лабораторного теста, результаты анализа спермы должны быть точными, чтобы иметь практическую ценность.25,26 Любой количественный результат должен быть в пределах допустимого диапазона «правильных ответов», т.е. его погрешность измерения (UoM) по отношению к установленным стандартам или порядкам: «Эксперт» лаборатории андрологии и репродукции человека должен безоговорочно добиться погрешности измерений (UOM) ± 10%26. Что касается любого медицинского лабораторного анализа, внутренний контроль качества (IQC) и внешний контроль качества (EQC) являются обязательными.26,27 Тем не менее, для того, чтобы схема EQC имела практическую ценность, она должна включать в себя возможность повышения качества. Лаборатории должно быть известно, насколько близки результаты по отношению к правильным значениям для того, чтобы иметь возможность провести необходимые тренинги и тем самым улучшить результаты, если они находятся за пределами допустимого диапазона погрешности.
Таким образом, результаты анализа характеристик спермы, полученные с помощью компьютерной системы CASA в клинической андрологической лаборатории должны быть в пределах ± 10% от контрольных значений для экспертной андрологической лаборатории (хотя и ± 20% могут быть приемлемы для обычной клинико- диагностической лаборатории). Здесь предполагается, что все клинические андрологические лаборатории соответствуют текущей принятой методологии анализа спермы «Золотой стандарт», определенной в нормативах Всемирной организации здравоохранения28, или в рекомендациях рабочей группы по проблемам андрологии в составе Европейского Общества по вопросам репродукции человека и эмбриологии26, а также считается, что все сотрудники лаборатории должны быть хорошо обучены, согласно протоколам и системам контроля качества. К сожалению, через 34 года после публикации первого лабораторного руководства ВОЗ для анализа спермы, это по-прежнему остается главным недостатком большинства андрологических лабораторий по всему миру. Последняя инспекционная проверка 40 клинико-андрологических лабораторий в 22 странах 3 года назад показала, что более 90% из них либо имеют несоответствия в плане правильного использования микроскопа, контроля температуры, общей стандартизации, аналитического контроля качества, либо неправильно выполняют технические инструкции ВОЗ.29 Недостаточное соответствие международным техническим инструкциям хорошо известно30,31, и, кажется, что это соответствие на особенно низком уровне в центрах искусственного оплодотворения, данные проверки, проведенные за последние 15 лет показали, что только 1 из 47 центров в 14 странах существенно соответствовали установленным стандартам для их андрологических лабораторных услуг.
При использовании компьютерной системы CASA существует также проблема обеспечения фиксированной толщины образца, которая должна быть сделана для анализа в приборе, и что толщина действительно не может превышать 20 мкм для надежного отслеживания сперматозоидов под микроскопом с объективом 10х. Хотя на рынке существует множество счетных камер для анализа спермы, все устройства с фиксированным покровным стеклом требуют наполнения под воздействием капиллярной силы и, следовательно, будут подвергаться эффекту Сегре-Зильберберга, что влияет на измеренную во время анализа концентрацию сперматозоидов в результате артефактов ламинарного потока, в результате чего, в зависимости от вязкости, будет иметь место недооценка концентрации на величину, достигающую 30% при нормальной вязкости.33,34 Тем не менее, счетные камеры, такие как 2X-CEL и Cell-VU, которые используют отдельное покровное стекло над каплями суспензии сперматозоидов («дроп-загрузку») не подвергаются воздействию этой ошибки. Следовательно, если бы CASA система использовалась для сравнения результатов оценки концентрации спермы, полученных с использованием капиллярных счетных камер с референсными значениями, полученными с помощью гематоцитометра, то это бы установило, что компьютерный анализ спермы CASA на самом деле имел изменчивую переоценку реальных значений, и, следовательно, результаты анализа были бы недостоверными.
Тщательное исследование, сравнивающее счетную камеру Маклера (10 мкм) и одноразовые счетные камеры фирмы Leja 20 мкм c гемоцитометром Нейбауэра показало, что камера Маклера является крайне неточной в определении концентрации сперматозоидов - как правило, она дает значительно завышенные значения, а счетная камера Leja может достичь сопоставимой с гемоцитометром точности, что позволяет использовать ее в клинических условиях.31 Тем не менее, эта эквивалентность была достигнута только путем определения времени, необходимого для капиллярного наполнения камеры и применения соответствующего поправочного коэффициента для эффекта Сегре-Зильберберга33,34 и предварительного разбавления спермы: ни один из этих этапов не осуществляется во время использования данной счетной камеры в обычной клинико-лабораторной практике. Кроме того, всегда будет оставаться вопрос о надежности образцов, даже полностью сжиженных и хорошо смешанных человеческих эякулятов при аликвотировании только 4 или 5 мкл, требуемых для наполнения камеры для анализа при помощи CASA.
Также следует подчеркнуть, что сравнение между системами не может быть основано на средних значениях или на корреляциях / линейной регрессии между парными значениями: оба метода скрывают реальные различия, которые существуют между конкретными повторными исследованиями. Вместо этого должны быть использованы графики Бланда-Альтмана «Пределы согласия» или «отклонения от заданного значения», которые показывают фактическую разницу между парными значениями, и, следовательно, могут быть использованы для определения того, находится ли точность каждого «нового метода» (или «специалиста») в пределах ± 10% от эталонного метода анализа. Это сравнительная техника «золотого стандарта», и отчеты, использующие другие статистические подходы, многие из которых, как правило, скрывают истинные масштабы существующего несоответствия, следует рассматривать с осторожностью. На самом деле, результат анализа графика Бланда и Альтмана всегда может быть основан на случайности, и эта возможность должна быть исключена с применением регрессионного анализа Passing и Bablok, используя, например, MedCalc (см. www.medcalc.be). Другим дополнением к анализу Бланда и Альтмана является регрессионный метод Деминга (также доступны в MedCalc), который предоставляет данные в установлении соответствия между разными методами, испытанными на дубликате, а также дает коэффициент отклонения.
КАКИЕ ФАКТОРЫ ОГРАНИЧИВАЮТ ФУНКЦИОНАЛЬНОСТЬ КОМПЬЮТЕРНОГО АНАЛИЗА CASA ДЛЯ ПРОВЕДЕНИЯ АНАЛИЗА СПЕРМЫ ЧЕЛОВЕКА?
Технология CASA широко используется с отличными результатами в лабораториях по выведению разных видов домашних и диких животных, однако сложно сказать то же самое применимо к клиническим лабораториям, где исследуют сперму человека. Те, кто использует его для этой цели (предположительно) считают, что его результаты являются более надежными, чем те, что может получить недостаточно обученный персонал, проводящий анализ спермы, и / или их низкая стоимость исследования не позволят проводить более точные испытания. Тем не менее, следует отметить, что, начиная с момента использования, система CASA очень хорошо работала на некотором количестве промытой человеческой спермы, которая, как правило, имеет очень высокую подвижность сперматозоидов и минимальное загрязнение при распаде клеток и появления дебриса. Ограничения, влияющие на способность CASA предоставлять точные результаты концентрации спермы и процент подвижных или постепенно подвижных сперматозоидов, делятся на две основные категории: биологические (Табл 1) и технические.
Таблица 1. Биологические факторы, влияющие на анализ CASA, сравнение образцов спермы человека и домашних животных
Параметр | Сперма животного (высшие животные) | Сперма человека (пациенты) |
Плодовитость/Рождаемость | Обычно характеризуется высокой плодовитостью во многих поколениях | В основном у данных видов низкая плодовитость, у пациентов, страдающих бесплодием является «худшей из худших» |
Наличие других клеток, дебриса и т.д., в сперме | В большинстве случаев «чистые» эякуляты | Обычно очень «загрязненные» эякуляты, содержащий много частиц и клеточного и другого дебриса (создающие большое количество фоновых помех) |
Вязкость спермы | Относительно низкая в большинстве видов | В большинстве случаев высокая; также показывает, «микро-неоднородность», осложняет взятие точных репрезентативных проб |
Морфология спермы | Высоко-упорядоченная у большинства видов, хотя в некоторых группах (например, у хищников) может быть много типов аномалий (голый цокор имеет более плейоморфные сперматозоиды, чем человек) | Высоко-плейоморфная |
Подвижность сперматозоидов | Обычно очень высокая, часто значительно выше 60% | Обычно низкая (часто <50%) Много мертвых сперматозоидов с агрегацией («слипанием») |
Количество сперматозоидов/концентрация спермы | Высокая концентрация (например, у многих видов домашних и диких животных > 1000 м мл-1); Образцы перед анализом, как правило, сильно разбавлены при помощи «разбавителя» | В большинстве случаев |
Центр технических ограничений по вопросам, связанным с анализом цифровых изображений и принципиально различными подходами, раньше определял подвижность сперматозоидов. В отношении последнего, человеческое наблюдение определяет и классифицирует подвижность сперматозоидов в соответствии с колебаниями жгутика и пространственного перемещения клетки (Табл 2), но инструменты системы CASA не могут анализировать на отслеживание движения головки сперматозоида. В экстремальных ситуациях, броуновское движение неподвижных объектов одинакового размера и внешнего вида до головок спермиев может быть ошибочно принято за подвижность сперматозоидов, и даже создания более точного определения непрогрессивной подвижности сперматозоидов может быть осложнено, когда нет возможности отследить движение жгутика. С точки зрения анализа изображений есть несколько проблем, которые вытекают из ошибок в различии сперматозоидов и семенной жидкости, а также неподвижных и подвижных объектов:
а. Когда несколько сперматозоидов слипаются вместе (даже всего два) или с дебрисом, в результате получается один цельный объект, который после оцифровки изображения будет слишком большим, чтобы классифицировать его по головке сперматозоида (принцип детекции основан на определении размера головки сперматозоида) и, следовательно, эти данные не будут включены в результат анализа. Это означает, что общая концентрация спермы будет снижена и, так как такие сперматозоиды, как правило, неподвижны (или по крайней мере непрогрессивны), соотношение поступательно-подвижных сперматозоидов будет увеличено. К сожалению, такие «микро-скопления» очень распространены в образцах спермы человека.
б. Особенно в устройствах, использующих негативный фазовый контраст оптики или темнопольное освещение (т.е., темный или черный фон), неправильное распознавание объектов семенной жидкости (например, крупные остатки отмерших клеток - дебрис), как «ложных» сперматозоидов остается больным вопросом. Очевидно, это приведет к увеличению общего количества сперматозоидов, находящихся в поле зрения.
в. Неподвижные сперматозоиды (или даже соответствующего размера дебрис) могут быть «взболтаны» колебаниями жгутика соседних подвижных сперматозоидов и быть ошибочно распознаны как подвижные сперматозоиды. Это бы увеличило показатель видимого движения сперматозоидов, а также общего количества сперматозоидов в случае взболтанного дебриса или других клеток.
г. Отслеживание подвижных сперматозоидов в результате столкновений (реальных или даже «кажущихся» столкновениями, когда сперматозоиды плавают рядом друг с другом в рамках пространственно-временной разграничении прибора) может привести к разделению трека движения сперматозоида на части и тем самым увеличить концентрацию спермы, установленную путем наблюдений, и соотношение подвижных и прогрессивно подвижных сперматозоидов. Даже если у система CASA есть алгоритмы исправления «умных» столкновений, по-прежнему могут существовать нарушения в траекторий клеток, и, следовательно, в их кинематике.
Использование позитивного фазового контраста оптики (наиболее распространенный тип таких оптических приборов) снизит неправильное определение дебриса, как головок сперматозоидов, но оно не может разрешить вопрос непрерывной оцифровки прилегающих сперматозоидов (± других клеток). Вопрос «дрейфа» клеток в образце также неизбежен, и анализы нельзя начинать, пока все видимые «движения жидкости» не прекратятся. Недавнее нововведение фильтра на «дрейф» в программном обеспечении SCA может противостоять этому артефакту (см ниже).
Таблица 2. Определение и классификация категорий подвижности сперматозоидов в сперме человека
Категория | Определение |
Неподвижность сперматозоидов | Колебания хвоста не выявлено |
Подвижность сперматозоидов | Зафиксированы колебания хвоста сперматозоида |
Непоступательная подвижность сперматозоидов | Колебания жгутика зафиксированы, но дистанция не пройдена (движение со скоростью <5 мкм с-1) |
Поступательная подвижность сперматозоидов | Расстояние преодолено ?5 мкм с-1, но <25 мкм с-1 |
Быстрая поступательная подвижность сперматозоидов | Расстояние преодолено ?25 мкм с-1 |
КАК ЭВОЛЮЦИОНИРОВАЛИ СОВРЕМЕННЫЕ СИСТЕМЫ КОМПЬЮТЕРНОГО АНАЛИЗА СПЕРМЫ CASA?
Несмотря на многие нерешенные проблемы, современное техническое развитие анализа CASA сильно продвинулось за последнее десятилетие, так что несколько современных систем CASA больше не «черные ящики», они содержат дополнительные (и часто настраиваемыми пользователем) настройки рабочих параметров, которые справляются с множеством проблем, ограничивавших возможности прошлых систем. Успешное решение многих этих вопросов анализа изображений на основе рентабельной доступности устройств оцифровки высокого разрешения и большей мощности вычислений в сочетании с программными функциями, такими как автоматизированное и / или интерактивное управление освещением, расширенные возможности фильтрации броуновского движения, фильтрация дрейфа, обнаружение хвоста сперматозоида, отслеживания движения сперматозоидов через столкновения, адаптивное сглаживание, чтобы получить средний путь сперматозоида , а также введение фракталов как кинематической меры, дали нам инструменты CASA, что, безусловно, является более удобным в использовании в клинических условиях и для анализа спермы человека, и для анализа спермы животных.
Hamilton Thorne системы IVOS-II и CEROS-II
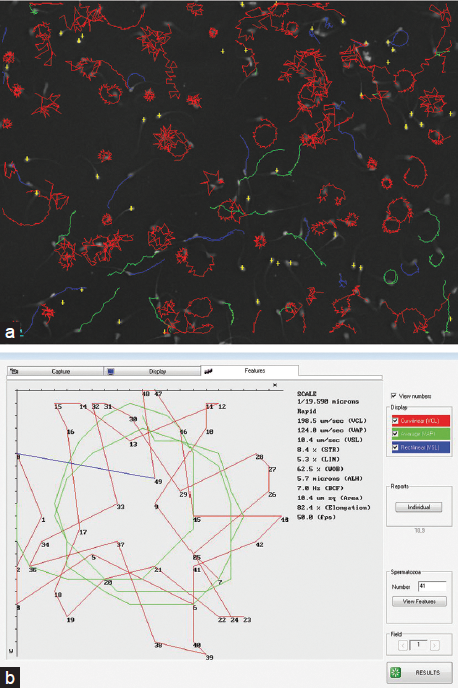
В последнее время мы (Дэвид Мортимер и Шерон Т Мортимер) работаем с CASA IVOS-II, которая имеет улучшенную интегрированную фазово-контрастную оптику; с высоким разрешением изображения; системой 1 мс стробоскопического освещения, которая синхронизируется с видео камерой со скоростью съемки 60 кадров /секунду (на самом деле, это минимальная частота изображения, требующаяся для получения надежного результата анализа спермы человека39), чтобы исключить «размазывание» изображений движущихся головок спермы; обнаружение хвоста сперматозоида для лучшего его распознавания; адаптивное сглаживание для лучшего выведения среднего пути (очень важно для анализа гиперактивности сперматозоидов с использованием обычных определений кинематики кинематики, см ниже); и улучшенное автоматизированное отслеживание пути сперматозоидов за счет их столкновений. Кроме того, ряд кинематических показателей был расширен за счет включения фрактальной размерности.40-43 В дополнение к традиционным функциональным настройкам, таким как частота кадров, количество изображений, которые будут захвачены, и образец типа счетной камеры / глубина, сейчас существует интерактивное / автоматизированное освещение и регулировка фокуса для оптимизации обнаружение хвоста сперматозоида, так же как и настройки, регулируемые в ручную для контроля других аспектов обнаружения клеток и дифференциации нулевой / непрогрессивной/ прогрессивной подвижности сперматозоидов. Общепринятая функция Сортировки в настоящее время обеспечивает больший контроль пользователя над булевыми определениями, которые могут быть созданы, чтобы классифицировать отдельные подвижные сперматозоиды в функциональные подгруппы, основанные на нескольких кинематических характеристиках (например, характеристики гиперактивных сперматозоидов, или тех, которые показывают «хорошую проникающую способность в слизь»)44. Как и раньше, в режиме просмотра результатов можно выбрать и увеличить отдельные треки движения сперматозоидов, чтобы показать детали трека и производные кинематических величин, но теперь отдельные кадры изображения сперматозоида, в том числе проксимальной части хвоста, также накладываются на воссозданный на картинке трек (рис 1). Это не просто отличный аналитический инструмент, но и хорошее обучающее средство, которое позволяет пользователям понять, как колебания жгутика сперматозоида перемещают головку сперматозоида и создать трек, который является основой для кинематического анализа. Встроенные люминесцентные опции изображений (на основе светодиодов или ксеноновых стробоскопов) позволяют обнаружить сперматозоиды только через их высоко конденсированные ядра (избежание проблем с дебрисом и жировыми капелями) либо когда сперматозоиды еще подвижны («VIADENT») или после их неподвижного состояния («IDENT»). Программное обеспечение CASA-II, который управляет платформой IVOS также может быть использовано в комплексе со стандартными внешними микроскопами как укомплектованная система анализа спермы CEROS-II, хотя это делает невозможным использование стробоскопической системы освещения, а также программного обеспечения на основе автоматизированных функций управления освещением IVOS платформы. Опции для изучения морфологии сперматозоидов включают ориентированную на исследования систему «Metrix», которая учится на взаимодействии с пользователем для улучшененной классификации морфологических параметров головки сперматозоида, и систему морфологических «Параметров»45, основанных на строгом критерии Тигерберга, единственное программное обеспечение для изучения морфологии спермы человека, которое было утверждено в больнице Тигерберга, теперь доступен в качестве новой платформы Dimensions II. Тем не менее, ни одна из этих систем не может проанализировать морфологию шейки или хвоста сперматозоида, и, следовательно, обеспечивает только классификацию «нормальных» сперматозоидов на основе определения морфологии головки – такой очень важный показатель, как индекс тератозооспермии19,26,46, определить невозможно.
 | Рис. 1.В верхней схеме показаны воссозданные треки сперматозоидов в анализе одного участка при помощи системы IVOS-II (1 с/60 Гц), фиолетовый треки это треки тех сперматозоидов, которые прошли сортировку булевой переменной, являясь гиперактивными. Нижняя схема показывает увеличенное изображение одного из этих треков, включая изображение сперматозоида в начале пути; Обратите внимание на высокую кривизну волну, характеристику гиперактивного сперматозоида, присутствующую в проксимальной области хвоста. Кинематические свойства клетки показаны в нижней части рисунка, в том числе фрактальная размерность, D, которая четко подтверждает гиперактивность сперматозоидов.60 |
В то время как система IVOS-II пользуется широким успехом в лабораториях по выведению новых видов животных, в момент создания оптимизации»клинической» программы IVOS-II (для анализа спермы человека) все еще находилась в процессе усовершенствования, чтобы лучше классифицировать непрогрессивные и прогрессивные сперматозоиды среди такого широкого диапозона эякулята пациента, какой только возможен. Решение вопросов, вытекающих из проблемы получения действительно репрезентативных аликвот от человеческого образца спермы, когда используется только 4-5 мкл спермы для наполнения счетной камеры для анализа CASA - вероятно, будет ограничивающим фактором в достижении сопоставимости между требованиями ВОЗ / ESHRE (Европейское общество по вопросам репродукции человека и эмбриологии) и результатами анализа спермы CASA - это работа, которая пока еще находится в прогрессе.
Анализатор качества спермы
Sperm Class Analyzer (SCA компании Microptic SL, Барселона, Испания) – это еще одна система CASA, которая достигла успеха в решении многих указанных выше проблем анализа изображений. Системы SCA 5.4 и SCA 6 Evolution содержат четыре модуля (концентрация и подвижность, морфология, жизнеспособность и фрагментация), которые полностью интегрированы и связаны со всеобъемлющей базой данных, что позволяет хранить и передавать результаты в разных форматах, используемых в больницах. Это дает возможность исследовать несколько платформ для анализа спермы человека или животных и некоторых других, включая этап автоматического анализа, обмен данными и использование станций, находящихся далеко от системы анализа. Тщательное тестирование первых двух модулей (Герхард ван дер Хорст и др.) охватило различные виды приматов (в том числе человека, как правило, с успешными результатами), всех одомашненных видов животных и более 60 других видов, включая беспозвоночных (например, мидии, морские ежи), несколько видов рыб, земноводных и птиц (например, страус, пингвин и зебровая амадина) и млекопитающих (в том числе крысы, мыши, слон, носорог и лев). Это одна из несколько систем, которые никогда не использовали видеоизображения, но все же она является полностью цифровой системой с определенными преимуществами, такими как возможность анализа с любой частотой кадров в рамках возможностей камеры. С камерами Firewire или Gigabit Ethernet может быть достигнута частота кадров до 100 кадров в секунду или даже выше. Как уже отмечалось, гиперактивные сперматозоиды человека в идеале должны быть изучены при скорости более 50 кадров в секунду, а сперматозоиды барана в среде культивирования должна быть изучены при скорости не ниже 75 кадров в секунду, предпочтительно даже 100 кадров в секунду. Свойства меню анализатора качества спермы SCA позволяют пользователям легко изменять многие необходимые для работы параметры, включая частоту кадров, количество захваченных кадров практически для любого типа счетных камер / глубины, референсные значения для определения неподвижных клеток и прогрессивной подвижности сперматозоидов, также как и для быстро, средне и медленно плавающих сперматозоидов, среднее сглаживание пути от 3 до 15 точек на трек (важно для оценки гиперактивации использовать показатель амплитуды латерального смещения головки ALH), и настройки, которые применяются для определения подвижности сперматозоидов практически любого вида животных. Никаких специальных модулей не требуется, таким образом в результате настройки программа может анализировать сперматозоиды различных видов, кроме того, настройки могут быть легко приспособлены и оптимизированы для любого нового вида. Также можно выбрать интеллектуальные фильтры, чтобы в дальнейшем оптимизировать распознавание сперматозоидов / обнаружение хвоста сперматозоида, исключение дебриса и расширенный анализ в черно-белом режиме (без оттенков серого) для образцов спермы с «чрезвычайно грязным» фоном (полным дебриса), также как и системный фильтр дрейфа клеток, в том числе для броуновского движения и по крайней мере отфильтровать последствия большинства столкновений. Вместе все эти особенности в значительной степени способствуют более точному определению процентного соотношения подвижности сперматозоидов. Анализатор качества спермы SCA также может выполнять два анализа на подвижность и жизнеспособность сперматозоидов одновременно в люминесцентном режиме (только распознавание ДНК), что исключает проблему появления дебриса в человеческой сперме и, у домашних животных, в жировых каплях при использовании растворителей на базе яичного желтка при криоконсервации для тестирования качеств при замораживании / оттаивании. Подвижность сперматозоидов в любой анализируемой области может быть воспроизведена с графическим наложением изображения треков в широкой цветовой гамме. Например, быстрые сперматозоиды представлены зеленым цветом, гиперактивные - желтым или разными цветами для сперматозоидов, относящихся к другим классам подвижности (ВОЗ 4/5). Наконец, можно увеличить трек любого анализируемого сперматозоида, чтобы показать подробную информацию о треке движения сперматозоида и сделать индивидуальный отчет по выбранной клетке. Это особенно значимо в установлении кинематических характеристик конкретной схемы подвижности сперматозоидов (рис 2). Тем не менее, как и все другие системы CASA, трудно провести точный анализ концентрации спермы и подвижность сперматозоидов, если вообще возможно, когда клетки сильно слипаются друг с другом. Модуль RatTox анализатора качества спермы SCA: система RatTox предназначена для изучения влияния различных веществ / токсикантов и на функции, и на формы сперматозоидов. SCA RatTox модуль измеряет подвижность сперматозоидов в сперме крыс и мышей (процентное соотношение и кинематику), морфометрия / морфология, жизнеспособность и фрагментацию в автоматическом режиме. Это единственная система CASA, который способна анализировать морфометрию спермы крыс и мышей, что является достаточно сложной задачей, учитывая крючкообразную форму головки сперматозоидов большинства грызунов, хотя в этом есть свое преимущество извлечения несколько «новых» морфометрических параметров, таких как общая длина головки кривой формы (кривая траектория). Система также имеет потенциал для морфометрических исследований спермы диких видов грызунов с крючковатой формой головки.
 | Рис. 2.Сперматозоиды абердин-ангусского быка стали гиперактивными при поддержании среды с 10 ммоль л-1 кофеина, анализ провели с использованием SCA (а). Многочисленные модели вращения сперматозоидов в форме звезд в верхней схеме можно легко выбрать и записать их индивидуальные кинематические значения (b).29 |
Развитие систем в будущем
Морфология спермы должна быть лучше изучена на образцах спермы человека и различных видов животных путем включения анализа клеток целиком, особенно характеристик хвоста сперматозоида, а также с использованием полихроматических красителей. Анализатор качества спермы SCA6 уже применяет пороговые значения для визуализации всего сперматозоида, а затем измеряет все его компоненты, по крайней мере, в сперме барана (рисунок 3). Там также должно быть больше единообразия в выборе красителей для использования в сочетании с прибором CASA, в частности те, которые являются изосмотическими и изотоническими по отношению к сперматозоидам и которые создают однородный фон, например SpermBlue. Другие подходы могут включать в себя устранение окраски и возможности более детального анализа с использованием фазового контраста и дифференциального интерференционно-контрастного микроскопа Номарского (ДИК).
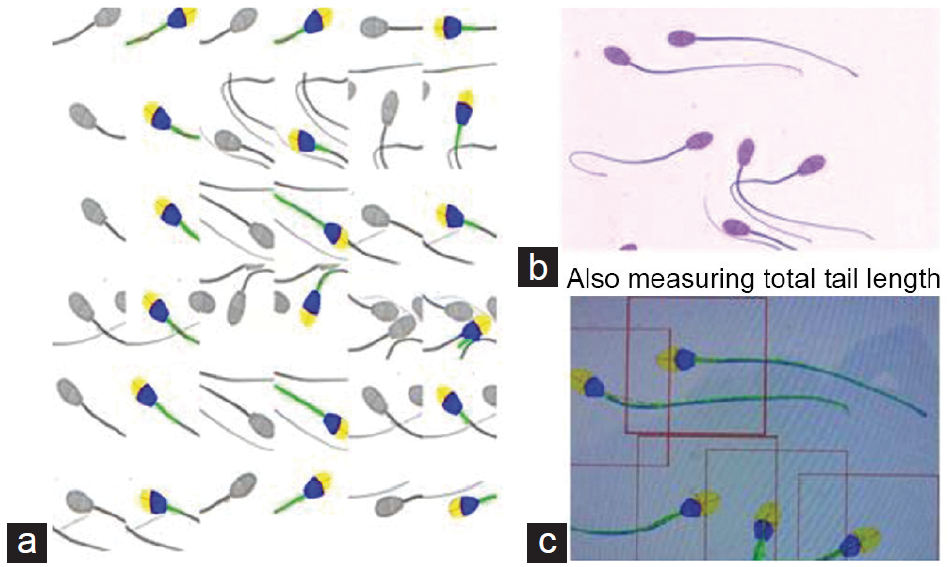 | Рис. 3.(а) SCA анализ сперматозоидов барана показывает три колонки парных изображений сперматозоидов, в каждом из которых левый подстолбец – это исходное изображение и правый подстолбец – это автоматизированный анализ каждого сперматозоида; желтый = акросома; синий = остальная часть головки сперматозоида; зеленый = передняя часть шейки. (б) Сперму барана окрашивают SpermBlue; (с) снимок экрана, где изображен всего сперматозоида в том числе его хвост, согласно анализу SCA. |
Современные системы CASA, такие как платформы IVOS-II и SCA6 открывают новые возможности для CASA в целом и позволят сделать важные научные открытия при помощи их способности анализировать несколько параметров и тем самым лучше определять качество образца спермы в количественном отношении и в реальном, на основе испытаний функциональной способности сперматозоидов, которые будут полностью автоматизированы. В этом контексте SCA6 также интегрировал в себя функциональную оценку спермы, используя несколько функций сортировки, такие как прохождение сперматозоидом цервикальной слизи и его гиперактивация, также как и анализ способности к акросомальной реакции. Модуль SCA Vitality предназначен для определения соотношения живых и мертвых сперматозоидов в автоматическом режиме в сперме человека и в сперме практически любых видов животных, но в ближайшем будущем также станет возможным автоматическое окрашивание эозином-негрозином, а это означает, что можно будет обойтись без дорогостоящей флуоресценции. Система SCA уже включает в себя автоматическую расшифровку теста Halosperm® (Halotech DNA SL, Мадрид, Испания) – метода проведения анализа степени фрагментации ДНК сперматозоидов. Будущее развитие данной области, которое предвидит компания Microptic, будет включать анализ прочих функциональных характеристик спермы, связанных со взаимодействием спермы и репродуктивного тракта женщины.
Также будет необходимо иметь более осмысленные расшифровки результатов, полученных с помощью CASA, по сравнению с результатами традиционного анализа спермы. Например, система SCA6 накладывает реальные результаты анализа образца пациента на референсные значения (например, ВОЗ 5-е изд.28) и выдает относительную оценку. В то время как такая стратегия может быть очень полезной, предполагается, что данное сравнение и оценка имеют реальный смысл в клинической андрологии.25 Тем не менее, путем интеграции различных источников информации, и целостного подхода в многомерном анализе, мы должны быть в состоянии достичь более глубокого, и патофизиологически более значимого, понимания того, как параметры могут определить «качество» спермы в функциональном плане.
КАК МЫ ДОЛЖНЫ ИСПОЛЬЗОВАТЬ КОМПЬЮТЕРНУЮ СИТЕМУ CASA ПРИ АНАЛИЗЕ ЧЕЛОВЕЧЕСКОЙ СПЕРМЫ?
Существует еще много споров о клинической пользы традиционного описательного анализа спермы, который проводится для выявления очень маленького прогностического значения и ограниченного диагностического значение, поскольку нет никакой «болезни» «бесплодия». В то время как, очевидно, невозможно поспорить с таким аргументом здесь, можно сделать вывод, что только с широким использованием надежных, точных методов мы можем ожидать появления возможности установить реальную клиническую пользу анализа спермы, и что такая практическая польза будет значительно увеличена при включении рассмотрения аспектов функциональной способности спермы.25,26,46
Есть два основных подхода к пониманию клинической пользы анализа спермы:
а. В качестве средства оценки репродуктивного здоровья человека; и
б. Содержит ли эякулят мужчины достаточно потенциально функциональных сперматозоидов, чтобы эффективно проникнуть в репродуктивный тракта партнера и достичь места оплодотворения в маточной трубе.
В отношении последнего, это количество сперматозоидов содержится в прогрессивно-подвижной фракции (класс «а»)46, и мы уже давно использовали кинематическое определение, когда сперматозоиды показывают характеристики «хорошей проходимости в слизи» (VAP>25 мкм с-1 и STR> 80% и ALH>2,5 мкм, где «И» термины логического аргумента)44,49. Если система CASA в состоянии вывести подкласс подвижных сперматозоидов в соответствии с множественностью параметров кинематических определений, например, Функция Отбора системы IVOS, фундаментальная способность определенная экспертами более чем 17 лет назад23, то это было бы клинически крайне важным критерием как в отличительном, так и в прогностическом значении в отношении ожидаемых результатов рождаемости в естественных условиях. Кроме того, это обеспечит биологически более важную информацию, чем характеристики традиционного анализа концентрации спермы, общего количества сперматозоидов, процентного соотношения подвижных и даже прогрессивно подвижных сперматозоидов, при выборе метода лечения и управлением техниками искусственного оплодотворения для бесплодных пар (хотя и не обязательно в равной степени мощную в отношении оценки общего репродуктивного здоровья человека). За последние 18 лет, мы (Дэвид Мортимер и Шерон Т. Мортимер) использовали анализ гиперактивации человеческой спермы, также как и определение доли прогрессивно подвижных сперматозоиды в сперме, как часть комплексной оценки функционального потенциала спермы, что позволяет более точно определить уровень вспомогательной терапии при искусственном оплодотворении, который может понадобиться паре (т.е., назначенный по определенное время половой акт, внутриматочная инсеминация, ЭКО или ИКСИ)44. Кроме того, эти прогностические факторы потенциала оплодотворения спермы, процентные соотношения быстрых, средних и медленно движущихся сперматозоидов в семенной жидкости также, по мнению многих андрологов, имеют большое значение, но в первую очередь, самым важным является процентное соотношение сперматозоидов с быстрым поступательным движением. Мари и Герхард ван дер Хорст (Maree and Gerhard van der Horst) описали способ определения пороговых значений VCL (линейности траектории) для этих подклассов у нескольких видов, включая человека при анализе SCA, и эти пороговые значения выявили различия в этой характеристике качества спермы среди различных фракций сперматозоидов, полученных путем центрифугирования в градиенте плотности и их реакции на кофеин (рис 4).
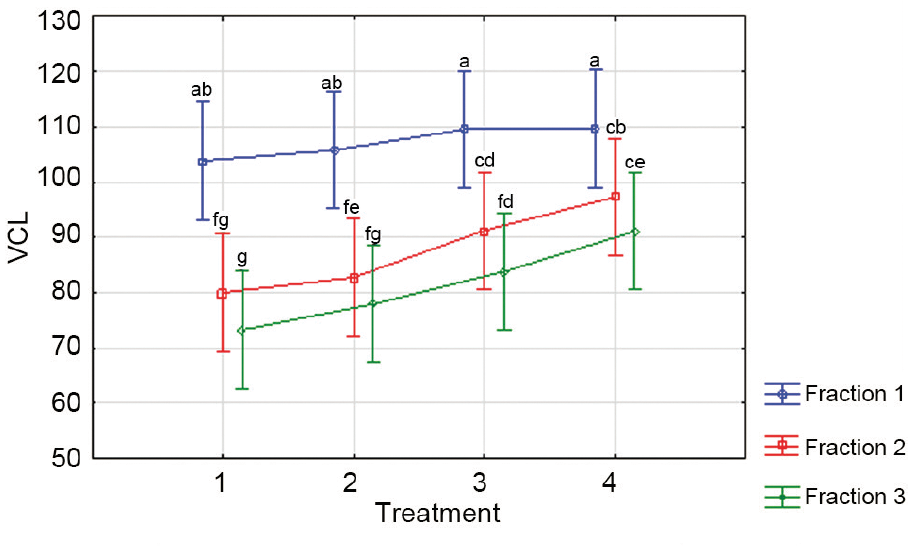 | Рис. 4.Процентное содержание быстрой поступательной-подвижности человеческой спермы из трех фракций PureSperm (Фракции от 1 до 3 = 40%, 60% и 80% соответственно) по сравнению, когда эту сперму выдержали в среде с возрастающими концентрациями кофеина; Процедура 1 = контроль; Процедуры 2-4 - повышение концентраций кофеина от 2 до 10 ммоль/л-1.51 |
АНАЛИЗ ГИПЕРАКТИВАЦИИ ЧЕЛОВЕЧЕСКИХ СПЕРМАТОЗОИДОВ
Гиперактивная подвижность является спутником капацитации, характеризуется относительно медленным развитием крупных жгутиковых волн, которые затем начинают распространяться очень быстро, что приводит описанию этого феномена как «хлыстовой» подвижности. Хотя точная физиологическая база для гиперактивной подвижности спермиев до сих пор однозначно не определена14, предположили, что это связано со способностью сперматозоида проникнуть в zona pellucida яйцеклетки. Следовательно, если сперматозоиды человека не в состоянии гиперактивности, то их оплодотворяющая способность снижается. В самом деле сообщалось, что концентрация гиперактивных сперматозоидов после 3 ч инкубации может объяснить до 50% разницы частоты оплодотворения при использовании метода клинического ЭКО.52 Таким образом, исследование гиперактивной подвижности в капацитирующей популяции сперматозоидов (в присутствии и в отсутствие агониста) было включено в исследование функции спермы, проводящееся при первоначальной обследовании для пар с бесплодием.44
В то время как гиперактивная подвижность является жгутиковым явлением, траектория головки сперматозоида - хороший показатель для моделирования движения жгутика, поэтому компьютерная система CASA является практичным вариантом для изучения гиперактивной подвижности сперматозоидов. Потому что амплитуда колебаний жгутиков может достигать 12 мкм в гиперактивном состоянии сперматозоидов53, было рекомендовано для анализа гиперактивации сперматозоидов использовать счетные камеры глубиной по крайней мере, 30 мкм21, хотя на начальных этапах исследований гиперактивации спермы человека были использованы более глубокие камеры54. Тем не менее, опыт, накопленный за последние 20 лет показал, что камеры глубиной в 20 мкм также могут быть использованы для надежного анализа гиперактивации сперматозоидов человека. При частоте съемки 60 Гц, Булевым аргументом для классификации гиперактивной подвижности человеческих сперматозоидов является: VCL>150 мкм с-1 и LIN <50% и ALH>7,0 мкм.55 Потенциальная проблема, связанная с этим аргументом, это то, что по результату анализа CASA, амплитуда латерального смещения головки (ALH) определяется путем расчета отклонения среднего пути от фактической, криволинейной траектории, - но точки, которые составляют средний путь сами рассчитывались из среднего значения точек на криволинейной траектории. С того момента как инструменты CASA используют различные алгоритмы для получения среднего пути, значения ALH не согласуется c измерительными приборами и поэтому не могут быть стандартизированы данным по CASA платформ. Более Старые Системы CASA, в которых все еще используются фиксированное пятибалльное сглаживание для получения значения среднего пути, обеспечат неточное сглаживание и, следовательно, сильно отклоняющиеся от нормы значения ALH. Альтернативный способ, который описывает степень отклонения траектории от прямой линии, и это не зависит от расчета ALH, - это фрактальная размерность (D).56
Фрактальная размерность является «количественной оценкой свойств заполнения пространства кривых на плоскости»57. По словам Мандельброта (Mandelbrot)56, в то время как прямая имеет одно измерение и плоскость имеет два измерения, изогнутая линия имеет размерность, которая находится между 1 и 2. Кац и Джордж (Katz and George)57 разработали алгоритмы, в которых простейшие траектории возвращаемых значений фрактальной размерности, близких к 1, с более сложных траекторий, дающих значения, приближающиеся 2 и рекурсивных траекторий, имеющих фрактальную размерность значений между 2 и 3, где «наслоения» траектории учитывается в третьем измерении. Дэвис (Davis) и Симерс (Siemers) предложили использовать для описания фрактальной размерности траектории сперматозоидов, и позднее было показано, что в дополнение к тому, независимо от среднего пути его вычисления, фрактальная размерность зависит от масштаба, так же как и от частоты дискретизации изображения42,43. В то время как D>1,30 описывает гиперактивную подвижность сперматозоидов, было отмечено, что одна фрактальная размерность вряд ли будет отслеживать треки гиперактивных сперматозоидов последовательно, и что она по-прежнему должна быть включена в логическое значение 40. До недавнего времени фрактальная размерность была включена в значения, получаемые при компьютерном анализе CASA (IVOS-II), и поэтому сейчас можно определить практическую ценность фрактальной размерности при определении гиперактивной подвижности. При использовании системы IVOS-II в общей сложности 6240 траекторий сперматозоидов человека, инкубированные в благоприятных условиях, были отслежены в течение 1 сек при 60 Гц. Классификация треков на гиперактивные или негиперактивные была установлена с использованием опубликованного логического аргумента для гиперактивации (VCL?150 мкм с-1 и LIN ?50% и ALH ?7.0 мкм), а также с помощью D>1,30, D>1,20, и VCL?150 мкм c-1 и D ?1.20 (Рис 5). Как и было предсказано, фрактальная размерность в одиночку не была последовательной в классификации траектории, с D>1,20 и D>1,30 давая только 63% и 67% совпадения с опубликованным логическим аргументом для гиперактивации, соответственно. Тем не менее, определение, которое входит и VCL и D дал 99% совпадения с опубликованным логическим аргументом в классификации траекторий.
Это разработка надежного определения для гиперактивации, которая не зависит от ALH, должна способствовать включению анализа на гиперактивацию в начальное клиническое обследование бесплодной пары, и способствовать созданию индивидуальных планов лечения.
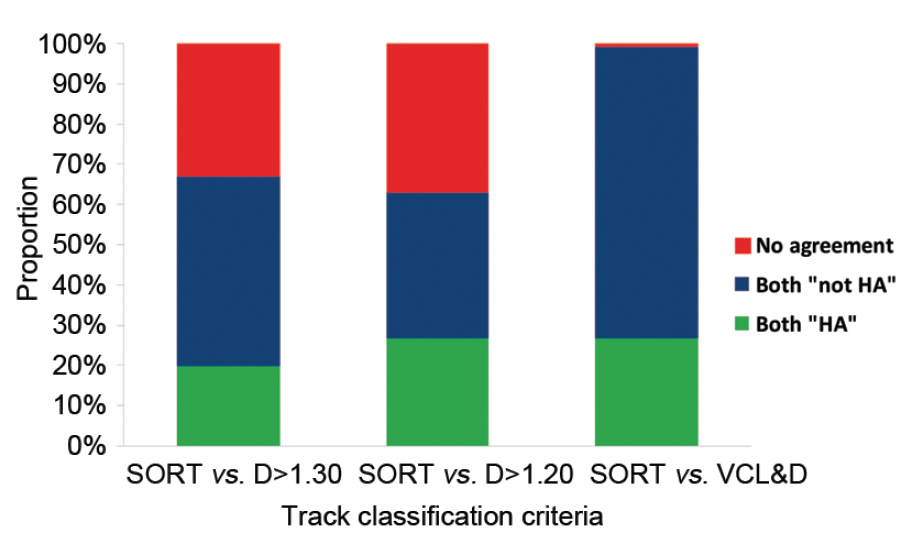 | Рис. 5.Сравнение методов классификации укрепления потенциала траекторий сперматозоидов при гиперактивной подвижности или негиперактивной подвижности спермиев (Мортимер, неопубликованные данные). |
АНАЛИЗ ГИПЕРАКТИВАЦИИ У ДРУГИХ ВИДОВ
Поскольку многие виды позвоночных и даже беспозвоночных не показывают большую степень «промежуточной» гиперактивации, как мы можем это видеть на примере сперматозоидов человека (гиперактивация, ранее называемая «переходным» типом, но теперь рассматриваемая как настоящая, основанная на колебаниях жгутиков таких сперматозоидов)58, они часто демонстрируют классическую «звездообразную» гиперактивацию, как показано на рис 2. Визуальные схемы распознавания этих сперматозоидов так или иначе являются относительно простыми по сравнению с более линейным передвижением сперматозоидов. Создание четких критериев для идентификации таких сперматозоидов – это относительно простой процесс, включая сравнение их кинематических параметров с теми, что связаны с движением сперматозоидов по прямой линии, используя операционную характеристику приемника (ROC) для анализа кривой: те кинематические параметры, которые показывают высокие уровни чувствительности и специфичности (>90%) затем используются для построения логического значения. Этот подход был успешно использован в сочетании с функцией сортировки SCA, чтобы установить уровень гиперактивации у многих видов, включая быка, барана, слона и носорога (работа сейчас ведется в лаборатории Герхарда ван дер Хорста). Используя аналогичный подход, было показано, что для спермы жеребца гиперактивация крайне необходима для оплодотворения ооцитов59.
ЗАКЛЮЧЕНИЕ
Компьютерный анализ спермы человека CASA имеет огромный потенциал в качестве инструмента исследования как в репродуктивной токсикологии, в животноводстве, так и для клинических анализов человека. Нет никаких сомнений в том, что будущие системы CASA необходимо будет тщательно протестировать и убедиться, что они соответствуют различным потребностям клинических андрологических лабораторий для взятия анализов спермы человека, лабораторий для выведения видов животных, научно-исследовательские лаборатории репродуктивного здоровья и для тестирование токсикологии. Кроме того, они также должны включать функциональные испытания качества спермы, которые будут помогать в определении значения относительной плодовитости, а не просто для описания измерений параметров спермы как таковых.
Тем не менее, особенно в области клинических анализов спермы человека, мы должны перестать пытаться использовать систему CASA там, где по своей сути применение данного компьютерного анализа является проблематичным для базовой технологии, до тех пор пока технология не будет улучшена и окончательно не будет утверждена. В настоящее время мы должны сосредоточиться на том, что мы знаем, что CASA может выполнять точно, и таким образом с точки зрения человеческого сперматозоида анализ включает в себя:
Анализ спермы: концентрация той подгруппы сперматозоидов, которые имеют правильную кинематику, чтобы проникнуть в слизь, выделяемую шейкой матки;
Анализ отмытой спермы: концентрация спермы и соотношение классов подвижности сперматозоидов; и
Способность оплодотворения спермы: оценка гиперактивации спермы, необходимой для оплодотворения, как в естественных условиях, так и в пробирке.
Срочные улучшения в технологии CASA необходимо произвести в технологии анализа морфологии сперматозоидов, а также в плане включения в анализ возможности выполнения функциональных тестов спермы. Будущие системы CASA могли бы обеспечить улучшенную клиническую значимость анализа спермы путем интеграции параметров автоматизированного анализа спермы и функциональных исследований спермы, и, возможно, даже включения молекулярно-биологических аспектов анализа спермы, в базу данных со специальными статистическими аналитическими возможностями. Такой подход может быть также принят для животноводства, чтобы лучше предсказывать относительную плодовитость самцов.
ЛИТЕРАТУРА
1 Грей Д. (Gray J.) Подвижность сперматозоидов морских ежей Журнал экспериментальной биологии (J Exp Biol, The Journal of Experimental Biology) 1955; 32: 775–801.
2. Грей Д. (Gray J.) Подвижность сперматозоидов быка. Журнал экспериментальной биологии (J Exp Biol) 1958; 35: 96–108.
3. Рикменспоель Р. , Ван Херпен Г. (Rikmenspoel R, van Herpen G.) Фотоэлектрические и кинематографические исследования подвижности сперматозоидов быка. Физика в медицине и биологии (Phys Med Biol) 1957; 2: 54-63.
4. Ротшильд Л., Суонн ММ. (Rothschild L, Swann MM.) Реакция оплодотворения яйцеклетки морского ежа по отношению к семени Журнал экспериментальной биологии (J Exp Biol) 1949; 26: 164-76, 4 pl.
5. Ротшильд Л. (Rothschild L.) Новый метод измерения скорости сперматозоидов. Природа (Nature) 1953; 171: 512-3.
6. Кац ДФ., Дотт ХМ. (Katz DF, Dott HM.) Методы измерения скорости передвижения сперматозоидов. Журнал репродукция и фертильность (J Reprod Fertil) 1975; 45: 263-72.
7. Дэвид Г., Серрес К., Жуане П. (David G, Serres C, Jouannet P.) Кинематика сперматозоидов человека. Исследование гаметы (Gamete Res) 1981; 4: 83–95.
8. Оверстрит ДВ, Кац ДФ, Хансон ФВ, Фонсека ДР. (Overstreet JW, Katz DF, Hanson FW, Fonseca JR.) Простой недорогой способ объективной оценки характеристик движения сперматозоидов человека. Фертильность и бесплодие (Fertil Steril) 1979; 31: 162–72.
9. Кац ДФ., Оверстрит ДВ. (Katz DF, Overstreet JW.) Оценка подвижности сперматозоидов с помощью видеомикрографии. Фертильность и бесплодие (Fertil Steril) 1981; 35: 188–93.
10. Ван дер Хост Г., Сэмюел Дж. (van der Horst G, Samuels J.) Новый видео графический метод анализа скорости сперматозоидов человека и быка. Южноафриканский журнал естествознания (S Afr J Sci) 1984; 80: 144.
11. Сэмюел ДжС, Ван дер Хост Г. (Samuels JS, van der Horst G.) Анализ подвижности сперматозоидов посредством видеосъемки Архивы андрологии (Arch Androl) 1986; 17: 151–5.
12. Кац ДФ, Дробнис ЕЗ., Оверстрит ДВ. (Katz DF, Drobnis EZ, Overstreet JW.) Факторы, регулирующие перемещение сперматозоидов по женским половым путям к яйцеклетке млекопитающих. Исследование гаметы (Gamete Res) 1989; 22: 443–69.
13. Девис РО., Сиемерс РД. (Davis RO, Siemers RJ.) Погрешность и надежность метода измерения кинематики движения сперматозоидов Репродукция, фертильность и развитие(Reprod Fertil Dev)1995; 7: 857–69.
14. Мортимер СТ. (Mortimer ST.) Критический обзор физиологического значения и анализа движения сперматозоидов млекопитающих. Известия репродукции человека (Hum Reprod Update) 1997; 3: 403–39.
15. Амман РП., Ваберски Д. (Amann RP, Waberski D.) Компьютерный анализ спермы (CASA): возможности и потенциальное развитие. Териогенология (Theriogenology) 2014; 81: 5–17.
16. Мортимер Д. Объективный анализ подвижности сперматозоидов и кинематики. В: Киль БА., Вебстер БВ., (Keel BA, Webster BW) редакторов. Справочник по лабораторной диагностике и лечению бесплодия. Boca Raton: CRC Press, Inc.; 1990. с. 97–133.
17. Всемирная организация здравоохранения. Руководство по лабораторному анализу спермы человека и смеси спермы с цервикальной слизью. 3-е изд. Кембридж: Издательство Кембриджского Университета, 1992. с. 107.
18. Каскар К., Франкен ДР., ван дер Хост Г., Крюгер ТФ. (Kaskar K, Franken DR, van der Horst G, Kruger TF.) Влияние пентоксифиллина на характеристики движения сперматозоидов и связывающего потенциала вителлинового слоя тератозооспермии мужчин. Репродукция человека (Hum Reprod) 1994; 9: 477–81.
19. Мортимер Д. (Mortimer D.) Практическая лаборатория Андрологии. Нью-Йорк: Издат. Оксфордского университета; 1994. с. 393.
20. Мортимер Д., Мортимер СТ. (Mortimer D, Mortimer ST.) Значение и надежность системы CASA. В: Омбелет В., Босманс Е., Вандерпут Х., Вереекен А., Рениер М. и др., редакторы (Ombelet W, Bosmans E, Vandeput H, Vereecken A, Renier M, et al., editors) Андрология в девяностых. Современное искусство в 2000-х годах. Карнфорт: Парфенон издательство; 1998. p. 73–89.
21. Мортимер Д., Аиткен РД., Мортимер СТ., Пейси АА., (Mortimer D, Aitken RJ, Mortimer ST, Pacey AA.) Отчет семинара: Клиническая CASA - Поиски консенсуса. Репродукция, фертильность и развитие (Reprod Fertil Dev) 1995; 7: 951–9.
22. Консенсус семинар по передовым методам диагностически в андрологии. ESHRE (Европейское общество репродукции человека и эмбриологии) группа влияния андрологии. Репродукция человека (Hum Reprod) 1996; 11: 1463–79.
23. Рекомендации по использованию технологии CASA для анализа сперматозоидов. ESHRE (Европейское общество репродукции человека и эмбриологии) группа влияния андрологии. Репродукция человека (Hum Reprod) 1998; 13: 142–5.
24. Зинаман МД., Анлер МЛ., Вертуно Е., Фишер СГ, Клегг ЕД. (Zinaman MJ, Uhler ML, Vertuno E, Fisher SG, Clegg ED.) Компьютерный анализ спермы (CASA) для определения концентрации сперматозоидов. Журнал андрологии (J Androl) 1996; 17: 288–92.
25. Бьорн Даль Л. ( Bj?rndahl L.) Что значит нормальное качество спермы? Об использовании и злоупотреблении граничных значений для интерпретации результатов анализа спермы. Фертильность человека (Кембридж) (Hum Fertil (Camb)) 2011; 14: 179–86.
26. Бьорн Даль Л., Мортимер Д., Барратт СЛ., Кастилия ДА., Менквелд Р. и др. (Bj?rndahl L, Mortimer D, Barratt CL, Castilla JA, Menkveld R, et al.) Практическое руководство по основам андрологии в лаборатории Кембридж: Изд. Университета Кембридж; 2010. с. 336.
27. Паласиос ЕР., Клаверо А., Гонзалво МС., Росалес А., Мозас Дж. и др. (Palacios ER, Clavero A, Gonzalvo MC, Rosales A, Mozas J, et al.) Допустимые отклонения внешнего качества в основном анализе спермы. Репродукция человека (Hum Reprod) 2012; 27: 314–22.
28. Всемирная организация здравоохранения. Лаборатория ВОЗ Руководство по экспертизе и обработке человеческой спермы. 5-е изд Женева: Всемирная организация здравоохранения ;. 2010 с. 271.
29. Ван дер Хорст Г. Неопубликованные данные.
30. Киль Б., Куинн Р, Шмидт СФ.-младший, Серафи НТ.-младший, Серафи НТ.-старший и др. (Keel BA, Quinn P, Schmidt CF Jr, Serafy NT Jr, Serafy NT Sr, et al.) Результаты Американской ассоциации национальных программ профессионального тестирования Bioanalysts в андрологии. Репродукция человека (Hum Reprod) 2000; 15: 680–6.
31. Бейли Е., Феннинг Н., Чемберлен С., Девлин Л., Хопкинссон Д. и др. (Bailey E, Fenning N, Chamberlain S, Devlin L, Hopkisson J, et al.) Проверка методов подсчета сперматозоидов с использованием предельных значений. Журнал андрологии (J Androl) 2007; 28: 364–73.
32. Бейли Е., Феннинг Н., Чемберлен С., Девлин Л., Хопкинссон Д. и др. (Bailey E, Fenning N, Chamberlain S, Devlin L, Hopkisson J, et al. Validation of sperm counting methods using limits of agreement. J Androl 2007; 28: 364–73.
33. Мортимер Д. (Mortimer D.) Неопубликованные данные.
34. Дуглас Гамильтон-DH, Смит Н.Г., Кастер СЕ., Вермейден ДП., Алтхаус ГС. (Douglas?Hamilton DH, Smith NG, Kuster CE, Vermeiden JP, Althouse GC.) Распределение частиц в малообъемных загруженных капиллярах. Журнал андрологии (J Androl) 2005a; 26: 107–14.
35. Дуглас Гамильтон-DH, Смит Н.Г., Кастер СЕ., Вермейден ДП., Алтхаус ГС. (Douglas?Hamilton DH, Smith NG, Kuster CE, Vermeiden JP, Althouse GC.) Гидродинамика в загруженных капиллярах: влияние на оценку концентрации спермы. Журнал андрологии (J Androl) 2005b; 26: 115–22.
36. Бленд ДМ., Алтман ДГ. (Bland JM, Altman DG.) Статистические методы анализа оценки соответствия двух клинических измерений. Ланцет 1986; 1: 307–10.
37. Пессинг Х., Баблок В. (Passing H, Bablok W.) Новый биометрический метод проверки равенства измерений двух аналитических методов. Применение линейной регрессии для сравнительных исследований в клинической химии, Часть I. Журнал клинической химии и клинической биохимии (J Clin Chem Clin Biochem) 1983; 21: 709–20.
38. Ван дер Хост Г., Китчин РМ., Ван дер Хост М., Атертон РВ. (van der Horst G, Kitchin RM, van der Horst M, Atherton RW.) Влияние размножения, криоконсервации и физиозаменителя на выбранную сперму: последствия разведения в неволе исчезающего вида американских хорьков. Репродукция, фертильность и развитие (Reprod Fertil Dev) 2009; 21: 351–63.
39. Леудерс И., Лютер И., Шеперс Г., Ван дер Хост Г. (Lueders I, Luther I, Scheepers G, van der Horst G.) улучшенный метод сбора спермы диких кошачьих: катетеризация уретры для получения высококачественных сперматозоидов африканских львов (Panthera leo). Териогенология (Theriogenology) 2012; 78: 696–701.
39 Мортимер Д., Серр С., Мортимер СТ., Жуане П. ( Mortimer D, Serres C, Mortimer ST, Jouannet P.) Влияние частоты дискретизации изображения на характеристики движения поступательно движущихся сперматозоидов человека. Исследование гаметы (Gamete Res) 1988; 20: 313–27.
40. Мортимер СТ., Свон МА., Мортимер Д. (Mortimer ST, Swan MA, Mortimer D.) Фрактальный анализ укрепления потенциала сперматозоидов человека. Репродукция человека (Hum Reprod) 1996; 11: 1049–54.
41. Мортимер СТ. (Mortimer ST.) Минимальная длина траектории спермы для надежного определения фрактальной размерности. Репродукция, фертильность и развитие (Reprod Fertil Dev) 1998; 10: 465–9.
42. Мортимер СТ., Свон МА. (Mortimer ST, Swan MA.) Развитие сглаживания независимых кинематических измерений потенциала движения сперматозоидов человека. Репродукция человека (Hum Reprod) 1999a; 14: 986–96.
43. Мортимер СТ., Свон МА. (Mortimer ST, Swan MA.)Влияние частоты дискретизации и сглаживания независимых кинематическиз величин на укрепление потенциала сперматозоидов человека. Репродукция человека (Hum Reprod) 1999b; 14: 997–1004.
44. Мортимер Д., Мортимер СТ. (Mortimer D, Mortimer ST.) Лаборатория исследования бесплодия у мужчин. В: Бринсден ПР., редактор (Brinsden PR). Учебник В-Экстракорпоральное оплодотворение и вспомогательная репродукция. 3-е изд Лондон: Медицинские книги Тэйлора и Фрэнсис; 2005. с. 61–91.
45. Кутзее К., Крюгер ТФ., Ломбард CД. (Coetzee K, Kruger TF, Lombard CJ.) Повторяемость и анализ погрешностей в определении морфологии (IVOS) спермы с помощью компьютера. Андрология 1999; 31: 163–8.
46. Баррат СЛ., Бьерндал Л., Менквелд Р., Мортимер Д. (Barratt CL, Bj?rndahl L, Menkveld R, Mortimer D.) Базовый курс анализа спермы: постоянное внимание на точность, качество, эффективность и клиническую значимость ESHRE (Европейское общество репродукции человека и эмбриологии) группа влияния андрологии. Репродукция человека (Hum Reprod) 2011; 26: 3207–12.
47. Ван дер Хост Г., Мари Л. (van der Horst G, Maree L.) SpermBlue®: новое универсальное контрастное вещество для спермы человека и животных, которое также доступно для автоматизированного анализа морфологии спермы. Биотехника и Гистохимия (Biotechnic Histochem) 2009; 84: 299– 308.
48. Мари Л., дю Плессии СС., Менквелд Р., ван дер Хост Г. (Maree L, du Plessis SS, Menkveld R, van der Horst G.) Зависимость морфометрических размеров головки сперматозоида от используемого контрастного вещества. Репродукция человека (Hum Reprod) 2010; 25: 1369–82.
49. Мортимер Д., Мортимер СТ. (Mortimer D, Mortimer ST.) Компьютерный анализ спермы (CASA) для изучения подвижности сперматозоидов и гиперактивации. В: Карелл ДТ., Астон АИ. (Carrell DT, Aston KI), редакторы. Сперматогенез и спермиогенез: Методы и протоколы. Методы молекулярной биологии. Том 927. Нью-Йорк: Спрингер (Humana Press); 2013. с. 77–87.
50. Мари Л., ван дер Хорст Г. (Maree L, van der Horst G.) Количественный анализ и идентификация спермы субпопуляцией с использованием компьютерного анализа и видоспецифичных пороговых значений для определения скорости. Биотехника и Гистохимия (Biotechnic Histochem) 2013; 88: 181–93.
51. Ньянтана Н. (Ntanjana N.) Гиперактивация человеческой спермы и субпопуляций сперматозоидов по отдельным модуляторам кальция. Диссертация, кафедра медицинской биотехнологии, Университет Западной Капской провинции, Южная Африка; 2015.
52. Сукахорен Н. Кейт Д., Ирвин ДС., Аиткен РД. (Sukcharoen N, Keith J, Irvine DS, Aitken RJ.) Определение оптимальных критериев для исследования гиперактивности сперматозоидов человека при 25 Гц с помощью экстракорпорального оплодотворения в качестве функциональной конечной точки. Репродукция человека (Hum Reprod) 1995; 10: 2928–37.
53. Мортимер СТ., Шовьерт Д., Своун МА., Мортимер Д. (Mortimer ST, Sch?v?ert D, Swan MA, Mortimer D.) Количественные исследования жгутиков сперматозоидов для моторики укрепления потенциала человека. Репродукция человека (Hum Reprod) 1997; 12: 1006–12.
54. Бэркмен ЛД. (Burkman LJ.) Характеристика гиперактивной подвижности сперматозоидов человека во время капацитации: сравнение фертильности и олигозооспермии. Архивы андрологии (Arch Androl) 1984; 13: 153–65.
55. Мортимер СТ., Своун МА., Мортимер Д. (Mortimer ST, Swan MA, Mortimer D.) Влияние семенной плазмы на капацитацию и гиперактивацию человеческих сперматозоидов. Репродукция человека (Hum Reprod) 1998; 13: 2139–46.
56. Манделблот ББ. (Mandelbrot BB.) Фрактальная геометрия природы. Нью-Йорк: Фриман ВХ. (Freeman WH.) и Компания; 1983.
57. Кац МЮ., Джордж ЕБ. (Katz MJ, George EB.) Фрактады и анализ путей роста Fractals and the analysis of growth paths. Периодическое издание математической биологии (Bull Math Biol) 1985; 47: 273–86.
58. Мортимер СТ., Мортимер Д. (Mortimer ST, Mortimer D.) Кинематика сперматозоидов человека инкубированных в условиях укрепления потенциала. Журнал андрологии (J Androl) 1990; 11: 195–203.
59. МакПртлин Л., Суарес СС., Кзая СА., Хинричс К., Бедфорд-Гаус СД. (McPartlin LA, Suarez SS, Czaya CA, Hinrichs K, Bedford?Guaus SJ.) Гиперактивация спермы жеребца для успешного экстракорпорального оплодотворения овоцитов лошадей. Биология репродукции (Biol Reprod) 2009; 81: 199–206.
04.09.2015г.





 Написать нам
Написать нам